Chikungunya

Hiermit bestätige ich, dass ich einen medizinischen oder pharmazeutischen Beruf ausübe [Ärzt*in, Apotheker*in, Pharmazeutisch-technische*r Assistent*in (PTA), Medizinische*r Fachangestellte*r (MFA)].
Inhaltsverzeichnis
Einführung
Das CHIKV (Chikungunya-Virus) ist ein durch Mücken der Gattung Aedes übertragenes Alphavirus (Familie Togaviridae), das eine globale Gesundheitsbedrohung darstellt. Eine Infektion mit dem CHIKV äußert sich in einer akuten fieberhaften Erkrankung, die als Chikungunya-Fieber bekannt ist. Die Infektion ist in der Regel selbstlimitierend und durch schwere Polyarthralgie und Myalgie gekennzeichnet (Schmerzen in den Gelenken bzw. in der Skelettmuskulatur). Diese können chronisch werden und bei einem erheblichen Teil der infizierten Personen zu einer rheumatischen Erkrankung führen [1]. Die durch das Chikungunya-Fieber verursachte Arthropathie (Gelenkerkrankung) hat erhebliche Auswirkungen auf die Lebensqualität der Betroffenen und führt zu wirtschaftlichen Verlusten, insbesondere in Entwicklungsländern.
Das CHIKV wurde erstmals 1952 auf dem Makonde-Plateau in Ostafrika entdeckt. Das Wort „Chikungunya“ leitet sich vom Kimakonde-Wurzelverb „Kungunyala“ ab, das „das, was sich nach oben biegt“, „sich verrenken“ oder „gebückt gehen“ bedeutet [2]. Zwischen den 1960er- und 1990er-Jahren wurden CHIKV-Ausbrüche in Asien und Afrika gemeldet. Man ging davon aus, dass das Virus in einem sylvatischen Zyklus (zyklische Übertragung zwischen Tierwirten und Insekten in Naturherden) mit gelegentlicher Übertragung auf den Menschen aufrechterhalten wird. Das Virus wird gesichert durch die Mückenarten Aedes aegypti und Aedes albopictus übertragen. Heute wird das CHIKV in mehr als 60 Ländern in Afrika, Asien, Europa und Amerika gemeldet – eine Folge der Globalisierung von Reisen und Handel sowie des Klimawandels, der zur Ausbreitung von Aedes-Mücken in immer mehr gemäßigten Regionen führt. Darüber hinaus hat sich die Aedes-albopictus-Mücke an etwas kältere Umgebungen angepasst und konnte sich so weltweit in immer mehr Regionen verbreiten [3]. Sylvatische Zyklen existieren immer noch in Afrika und wahrscheinlich auch in Teilen Asiens. Die Übertragung in städtischen Gebieten zwischen Menschen und Mücken gewinnt jedoch zunehmend an Bedeutung [4].
Epidemiologie
CHIKV ist das am weitesten verbreitete Alphavirus. Es wird durch den Stich einer weiblichen Aedes-Mücke auf den Menschen übertragen [1]. Die häufigste Übertragung von CHIKV auf den Menschen steht im Zusammenhang mit periurbanen oder städtischen Populationen von Aedes aegypti. Aber in den letzten Jahrzehnten hat Aedes albopictus, ursprünglich eine zoophile, waldbewohnende Mückenart aus Asien, als Überträger von CHIKV zunehmend an Bedeutung gewonnen [6].
Durch phylogenetische Analysen wurden 3 verschiedene Abstammungslinien identifiziert, die ihrer jeweiligen geografischen Herkunft entsprechen [7]:
- westafrikanische Abstammungslinie,
- ost- und zentralafrikanische Abstammungslinie (ECSA),
- asiatische Abstammungslinie.
Seit seiner Entdeckung im Jahr 1952 verursachte das CHIKV sporadische Ausbrüche in Afrika südlich der Sahara. Im Jahr 2004 tauchte ein ECSA-CHIKV-Stamm in Kenia auf und breitete sich anschließend auf die Inseln im Indischen Ozean aus. Dort kam es zu Ausbrüchen von beispiellosem Ausmaß, insbesondere auf La Réunion [1] [7]. Dieser Ausbruch hat zur Entstehung einer 4. phylogenetischen Linie geführt, die als Abstammungslinie des Indischen Ozeans bezeichnet wird und sich anschließend nach Asien und Indien ausgebreitet hat. Es kam seitdem wiederholt zu autochthonen Übertragungen im europäischen Mittelmeerraum (Italien und Frankreich) [7]. Im Dezember 2013 fand ein weiterer großer Ausbruch statt, als ein Stamm der asiatischen Linie erstmals auf der Karibikinsel Saint Martin auftauchte, von wo aus sich das Virus auf mehr als 50 Länder des südamerikanischen Kontinents ausbreitete und schätzungsweise eine Million Infektionen verursachte [7]. Im Jahr 2014 wurde die ECSA-Linie im Nordosten Brasiliens gemeldet, wo sie bis heute als der am weitesten verbreitete Stamm zirkuliert.
Der Großteil der Linie im Indischen Ozean ist durch eine adaptive Mutation im E1-Glykoprotein gekennzeichnet, die erstmals 2005 in der ECSA-Linie gemeldet wurde, in anderen Linien jedoch nicht vorkommt. Die E1-A226V-Mutation wurde als Ursache für eine 40-fache Zunahme der Übertragung durch Aedes-albopictus-Mücken festgestellt, ohne die virale Fitness (Replikationseffizienz) beim ansonsten wichtigsten Vektor Aedes aegypti zu beeinträchtigen. Ähnlich wie E1-A226V ist die Mutation E2-L210Q für die verstärkte Verbreitung von CHIKV in Aedes albopictus verantwortlich, indem es die Infektiosität für Epithelzellen erhöht, die den Mitteldarm der Mücke auskleiden [8].
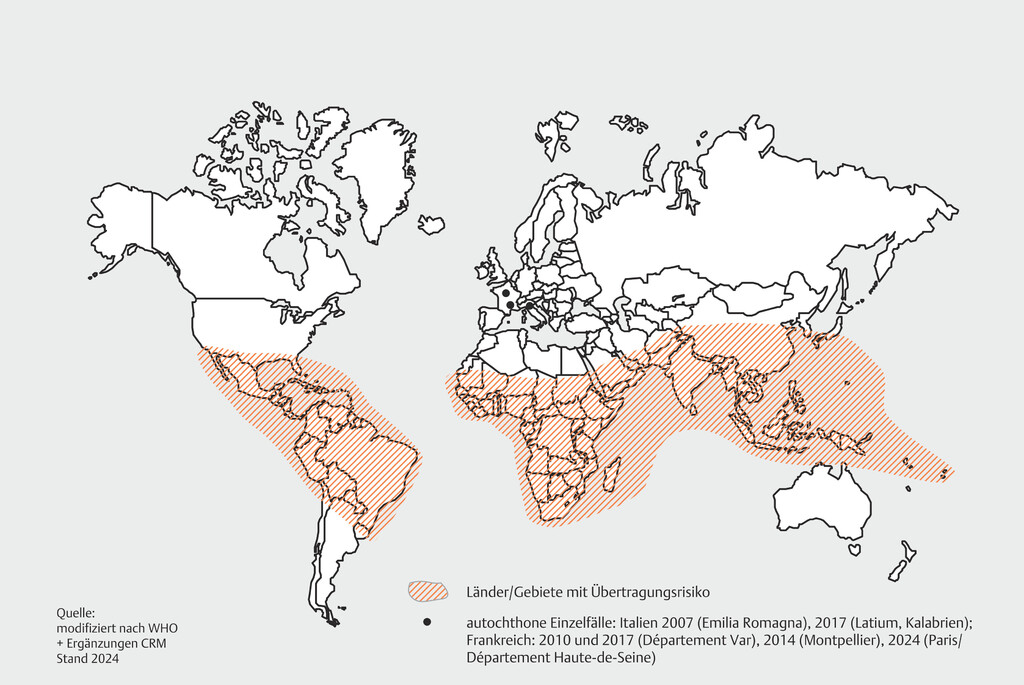
Abgesehen von der wiederholten viralen Anpassung an Aedes albopictus [8] ist insbesondere die Globalisierung von Reisen und Handel die Hauptantriebskraft für die Ausdehnung des Lebensraums von Aedes albopictus und, in etwas geringerem Maße, von Aedes aegypti in gemäßigten Regionen. Im Gegensatz zu Aedes aegypti ist Aedes albopictus besser an kalte Winter angepasst und kann daher in Regionen leben, die außerhalb der historischen Verbreitung der Aedes-Mücke liegen [2] [4]. Zusammen haben die Anpassung der Viren, der Klimawandel und die Globalisierung zu einer geografischen Ausbreitung von CHIKV über die Tropen und Subtropen hinaus geführt. Mehr als 100 Länder berichten über die Zirkulation von CHIKV, sodass schätzungsweise 1,3 Milliarden Menschen weltweit dem Risiko von Chikungunya-Fieber ausgesetzt sind ([Abb. 1]) [9] [10]. Vorhersagen aus Klimamodellen lassen eine Übertragung von CHIKV in zahlreichen Gebieten der Welt in Zukunft wahrscheinlicher werden, darunter in Teilen Chinas, in Subsahara-Afrika, in Europa und Amerika [3].
Abb. 1 Geografische Verbreitung des Chikungunya-Virus.
Quelle: Jelinek T. CRM Handbuch Reisemedizin 2024. 60. Aufl. Düsseldorf: CRM Centrum für Reisemedizin; 2023; angepasst von Prof. Tomas Jelinek
CHIKV-Infektion
Die umhüllten Viruspartikel sind kugelförmig und haben einen Durchmesser von 65 nm. Es wird angenommen, dass der Eintritt von CHIKV in Wirtszellen hauptsächlich durch Endozytose nach Bindung eines Membranrezeptors erleichtert wird [11]. Während einer Blutmahlzeit an einer infizierten Person nimmt die weibliche Mücke das Virus auf, das verschiedene Mückengewebe einschließlich der Speicheldrüsen infiziert.
Bei einer anschließenden Blutmahlzeit der infizierten Mücke wird das Virus zusammen mit dem Mückenspeichel durch Injektion in die Haut auf eine nicht infizierte Person übertragen [7]. Dabei gelangt virushaltiger Speichel in die Dermis und möglicherweise direkt in den Blutkreislauf. Die anfängliche Replikation in Zellen der Dermis produziert Viren, die in den Blutkreislauf gelangen oder sich durch infizierte wandernde Zellen in die drainierenden Lymphknoten ausbreiten können, möglicherweise auch als freies Virus durch die Lymphflüssigkeit. Die meisten Arboviren weisen denselben Infektionsweg und einen breiten zellulären Tropismus auf. Hingegen deuten die durchweg kurze Inkubationszeit (3–12 Tage) der CHIKV und die bemerkenswert hohe Virämie auf Besonderheiten bei der Ausbreitung und Replikation bei infizierten Menschen im Vergleich zu anderen Arboviren hin. Da die meisten verfügbaren Daten aus In-Vitro-Experimenten stammen, ist man allgemein der Ansicht, dass die lokale Infektion von Langerhans- und dendritischen Zellen es dem Virus ermöglicht, sich auf drainierende Lymphknoten auszubreiten, wenn die Zellen wandern, um die adaptive Immunantwort auszulösen [7].
Ein Vergleich der Infektiosität von Alphaviren in Gegenwart und Abwesenheit von Mückenspeichel zeigte eine wichtige provirale Rolle von Komponenten des Mückenspeichels durch Modulation der lokalen Immunantwort, Förderung des Zustroms anfälliger myeloischer Zellen und Beibehaltung von Virus und permissiven Zellen nach lokalem Ödem [12]. Es wird angenommen, dass die Virusvermehrung in Leber und Milz sowie die Infektion von Endothelzellen und Monozyten im peripheren Blut zur typischen hohen Virämie beitragen.
Während der akuten Phase der Erkrankung infiziert das CHIKV Makrophagen und Fibroblasten in den Synovialgelenken. Dies führt zu Gewebezerstörung, treibt die Produktion entzündungsfördernder Zytokine an und regt den Zustrom von Immunzellen einschließlich Makrophagen, T-Zellen, B-Zellen und natürlichen Killerzellen an. Dadurch entsteht eine entzündliche Umgebung, die die charakteristischen arthritischen Gelenkschmerzen antreibt [13].
Trotzdem wurde angenommen, dass eine langfristige Infektion der synovialen Makrophagen ein wichtiger Faktor für die anhaltende Immunreaktivität im Gelenkgewebe ist. Es wurde vermutet, dass die initiale Viruspersistenz zu den chronischen arthritischen Gelenkschmerzen beiträgt, unter denen viele Infizierte leiden [14]. Darüber hinaus erklärt die Infektion von Osteoblasten und Chondrozyten die Bindegewebsschädigung und den Knochenverlust, die bei den am stärksten von einer CHIKV-Infektion Betroffenen beobachtet wurden. Der effektive Einsatz von immunsuppressiven Therapien bei der Behandlung von chronischen Post-Chikungunya-Arthritiden und das Fehlen nachweisbarer viraler Proteine oder RNA (Ribonukleinsäure) in der Gelenkflüssigkeit von Patienten mit chronischen Gelenkschmerzen lassen jedoch auf die Beteiligung anderer Krankheitsmechanismen schließen.
Pathophysiologie und Immunologie
Akute Erkrankung
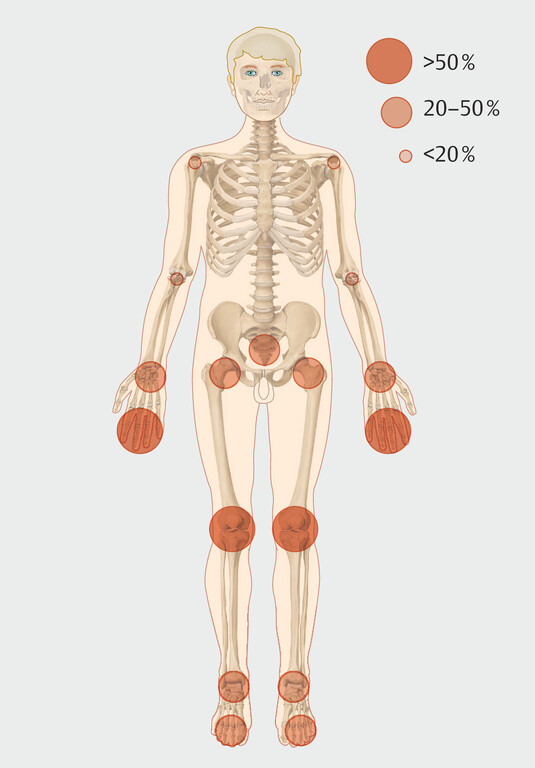
Hautausschlag ([Abb. 2]), Fieber und Gelenkschmerzen bilden die klinische Trias einer CHIKV-Infektion. Wie bei anderen Arboviren auch variiert die Schwere der Erkrankung jedoch stark und reicht von einer leichten selbstlimitierenden Erkrankung über schwere neurologische Manifestationen bis hin zu langanhaltenden, stark einschränkenden Arthralgien ([Abb. 3] und [Tab. 1]).
Abb. 2 Exanthem und weißer Dermografismus bei Chikungunya.
Abb. 3 Manifestationen der Arthritiden bei Chikungunya (nach [2]).
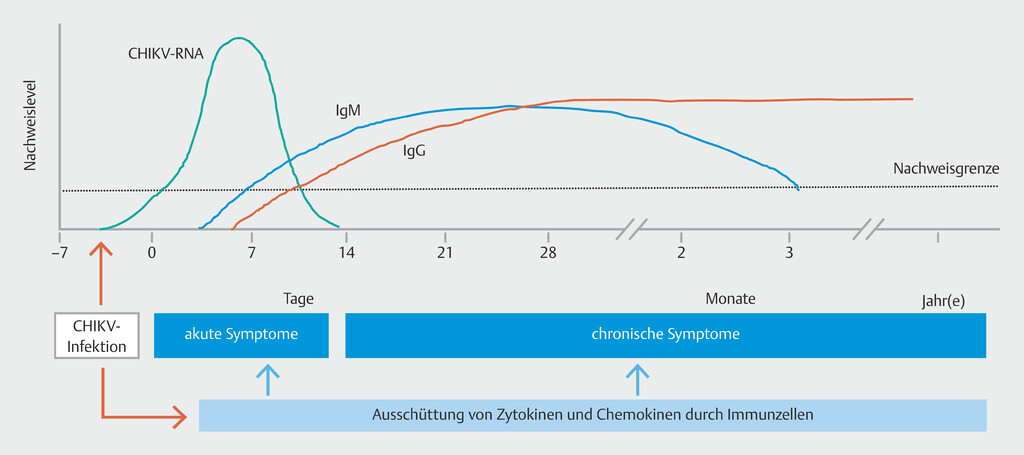
Die Erstinfektion ist durch eine hochgradige Virämie gekennzeichnet, die von einer starken angeborenen Immunantwort begleitet wird ([Abb. 4]) [2] [7] und nach einer Inkubationszeit von 4–7 Tagen zu einem plötzlichen Fieberanfall führt. Das Fieber ist oft hoch (39°C und darüber), nach 4–5 Tagen lässt es aber nach. Die Virämie klingt in der Regel 8 Tage nach Auftreten der Symptome ab, es wurde jedoch auch über längere Zeiträume von bis zu 10–12 Tagen berichtet.
Abb. 4 Krankheitsverlauf und Diagnostik bei Chikungunya (nach [2]).
CHIKV = Chikungunya-Virus, Ig = Immunglobuline, RNA = Ribonukleinsäure.
Lähmende Gelenkschmerzen sind ein auffälliges Symptom während einer akuten Infektion, das 2–5 Tage nach dem Fieber einsetzt. Arthralgien treten in der Regel symmetrisch auf und betreffen eher die distalen als die proximalen Gelenke. Während sie meist selbstlimitierend sind und bei mehr als 50% der Patienten nach einem Monat abklingen, kann sich auch eine chronische Arthritis entwickeln [14]. In-Vitro- und Tiermodelle deuten darauf hin, dass das CHIKV Makrophagen direkt infiziert. Daraufhin werden entzündliche Zytokine im Gelenkraum freigesetzt. Darüber hinaus kann CHIKV menschliche Osteoblasten direkt infizieren, mit der Folge eines Abbaus von Knochensubstanz.
Etwa 2 Drittel der Infizierten entwickeln während der akuten Infektion ein vorübergehendes, makulopapulöses Exanthem, das schuppend abheilt. Es wurde auch über eine Beteiligung der Schleimhäute berichtet.
Abgesehen von der Trias aus Fieber, Arthralgie und Exanthem können bei einer akuten CHIKV-Infektion verschiedene zusätzliche Symptome auftreten:
- Neurologische Manifestationen: Obwohl selten, sind neurologische Manifestationen die besorgniserregendste akute klinische Komplikation, da sie in erhöhtem Maße mit der Einweisung auf die Intensivstation und dem Tod in Verbindung gebracht werden [15]. Es wurde wiederholt beschrieben, dass CHIKV das zentrale Nervensystem infiziert und eine Vielzahl von Symptomen verursacht, von Enzephalopathie bis hin zu akuter disseminierter Enzephalomyelitis [7] [15]. Am ehesten entwickeln Patienten an beiden Enden des Altersspektrums neurologische Symptome der Infektion.
- Okuläre Manifestationen: Eine systematische Studie ergab, dass bei etwa einem Viertel der Patienten eine Augenbeteiligung durch eine CHIKV-Infektion vorlag. Dabei waren Entzündungen, Sehstörungen und Schmerzen die häufigsten Symptome und Konjunktivitis und Optikusneuritis die häufigsten Anzeichen [15]. Seltener wurden auch Uveitis, eine Hornhautbeteiligung, Episkleritis, Retinitis und exsudative Netzhautablösungen festgestellt.
Manifestationen im Blutbild: Im Vergleich zum Dengue-Virus sind Laboranomalien bei einer Infektion mit CHIKV in der Regel weniger auffällig. Es kann eine leichte Thrombozytopenie beobachtet werden, aber die Thrombozytenwerte bleiben in der Regel oberhalb von 100 000/µl, mit einer sehr geringen Inzidenz hämorrhagischer Komplikationen. Lymphopenie wurde als häufigste Laboranomalie gemeldet. Eine Erhöhung der Transaminasenaktivität wird selten beobachtet und ist in der Regel leicht. Schließlich wird häufig über eine Hypokalzämie berichtet, die Ursachen dafür sind aber nicht bekannt.
Chronische Erkrankung
Nach der akuten Infektionsphase entwickeln einige Betroffene chronische Gelenkschmerzen. Die postakute Phase erstreckt sich von 21 Tagen bis zu 3 Monaten nach dem Auftreten der Symptome.
Das Chikungunya-Fieber gilt als chronisch, wenn die klinischen Symptome, bei denen Arthralgien überwiegen, länger als 3 Monate anhalten [13].
Die Manifestation scheint vom Alter der Patienten und dem CHIKV-Genotyp abzuhängen. Bei 40–80% der Infizierten wird jedoch von einer chronischen Erkrankung ausgegangen. Eine erhöhte Viruslast sowie Arthralgien, Gliederschmerzen und Schwäche während einer akuten Infektion sind mit einem erhöhten Risiko für die Entwicklung chronischer Arthralgien verbunden. Darüber hinaus sind Personen mit einer zugrunde liegenden Arthrose eher betroffen [14]. Dauer und Prävalenz von anhaltenden Arthralgien variieren und können von der Dauer der Nachbeobachtung abhängen. Aber die meisten Schätzungen gehen davon aus, dass ein Viertel der Patienten auch nach einem Jahr noch betroffen ist [14].
Chronische Arthralgien aufgrund einer CHIKV-Infektion werden oft mit rheumatoider Arthritis verglichen, sowohl in Bezug auf die entzündliche Pathogenese (die Interleukine IL-17 und IL-6 sind beide an der rheumatoiden Arthritis beteiligte Zytokine) als auch in Bezug auf die klinischen Merkmale. Eine Studie ergab, dass ein Drittel der über 200 Patienten mit CHIKV-assoziierten chronischen Arthralgien die Kriterien für rheumatoide Arthritis erfüllten. Die Rheumafaktorbewertung ist selten positiv [16]. Aber eine Studie zeigte einen hohen Anteil an Patienten mit positiven Anti-CCP-Antikörpern (CCP = citrullinierte Proteine), die ein Marker für rheumatoide Arthritis sind [16]. Die bildgebenden Befunde sind bei beiden Krankheitsformen ähnlich und umfassen chronische erosive Veränderungen, Gelenkergüsse, Knochenmarködeme, Synovialverdickungen und Sehnenscheidenentzündungen. Aufgrund dieser Ähnlichkeiten werden zur Behandlung chronischer CHIKV-Arthralgien häufig DMARD (krankheitsmodifizierende Antirheumatika) eingesetzt.
Risikofaktoren
Eine Infektion mit CHIKV ist meist selbstlimitierend. Zunehmend kristallisiert sich aber ein wesentlich komplexeres Spektrum weniger häufiger und schwerer atypischer Manifestationen heraus [7]. Die Hospitalisierungs- und Sterblichkeitsrate bei einer Infektion mit CHIKV liegt zwischen 0,6 und 13,0% bzw. zwischen 0,024 und 0,800%. Die Risikofaktoren für die Entwicklung schwerer Formen von Chikungunya-Fieber und die Sterblichkeit sind kaum erforscht. In einer Studie, die an einer Population brasilianischer Patienten aus der Epidemie von 2016–2017 durchgeführt wurde, wurden als Risikofaktoren für die Sterblichkeit vor allem Adipositas, vorbestehende Herz- oder Niereninsuffizienz und das Vorhandensein von Fieber, Bauchschmerzen, Atemnot, Apathie oder Zytopenie bei der Aufnahme in das Krankenhaus genannt. Der Schweregrad des Verlaufs scheint auch mit dem viralen Genotyp zusammenzuhängen. Dabei wird eine allgemeine Komplikationsrate von 50% (95%-Konfidenzintervall: 40–60%) und 36% (95%-Konfidenzintervall: 20–52%) mit der ECSA-Linie bzw. der asiatischen Linie in Verbindung gebracht [17].
Diagnostik
Da sich das klinische Erscheinungsbild des Chikungunya-Fiebers oft nicht von dem anderer Arbovireninfektionen unterscheiden lässt, ist für eine definitive Diagnose der Einsatz diagnostischer Tests erforderlich. Während der akuten Phase der Infektion ist es möglich, das Vorhandensein von viraler RNA in Serumproben nachzuweisen. Nach dem Höhepunkt der Virämie lässt sich das Chikungunya-Fieber besser indirekt mit serologischen Methoden diagnostizieren. Während der ersten 8 Tage einer CHIKV-Infektion ist der Nachweis viraler RNA im Serum mittels PCR (Polymerasekettenreaktion) die bevorzugte Diagnosemethode [2]. Bei einem negativen PCR-Ergebnis sollte ein IgM-Antikörpertest (Ig = Immunglobuline) durchgeführt werden, wenn die Probe mindestens 4 Tage nach Auftreten der Symptome entnommen wurde. Eine Bestätigung positiver IgM-Testergebnisse durch einen Neutralisationstest ist zu empfehlen.
CHIKV-spezifische IgM-Antikörper entwickeln sich normalerweise gegen Ende der ersten Krankheitswoche (4–5 Tage nach Auftreten der Symptome) und erreichen etwa 3–5 Wochen nach Ausbruch der Krankheit ihren höchsten Wert. Sie bleiben etwa 2 Monate lang nachweisbar. Um die Diagnose definitiv auszuschließen, sollten daher Proben aus der Rekonvaleszenzphase von Patienten entnommen werden, deren Proben aus der Akutphase negativ getestet wurden. Ein positiver CHIKV-IgM-Test deutet auf eine aktuelle CHIKV-Infektion oder eine Infektion in den letzten 2 Monaten hin, insbesondere bei Patienten mit lang anhaltender Arthralgie.
Serologische Tests sind sowohl als Hochdurchsatz-Laborimmunoassays als auch als Einwegschnelltests (RDT [Rapid diagnostic Tests]) erhältlich. Diese liefern schnell ein Ergebnis (nach 15–20 min). Die Leistung dieser serologischen Tests hat sich jedoch als sehr variabel erwiesen, mit der Gefahr falsch-positiver Ergebnisse aufgrund von Kreuzreaktionen. Eine umfassende Überprüfung der Landschaft der Chikungunya-Fieber-RDT ergab 43 Produkte, die entweder kommerziell verfügbar sind oder sich in der Entwicklung befinden [18]. Die Ergebnisse von 11 Studien zeigten, dass die Sensitivität der IgM-Komponente des RDT bei 20–100% und die Spezifität bei 73–100% lagen. Kreuzreaktivität wurde gegenüber verwandten Alphaviren wie dem Mayaro-Virus und sogar Flaviviren (Dengue-Virus) nachgewiesen. Das kann eine zuverlässige Diagnose erheblich beeinträchtigen. Das Mayaro-Virus kommt zwar nur auf dem amerikanischen Kontinent vor, andere eng verwandte Alphaviren mit potenzieller Kreuzreaktivität sind jedoch fast in ganz Afrika, Asien und Europa verbreitet.
Eine retrospektive Diagnose von Chikungunya-Fieber kann auch durch den Nachweis eines 4-fachen Anstiegs der IgG-Antikörpertiter zwischen Serumproben erfolgen, die während der akuten und der Rekonvaleszenzphase der Infektion entnommen wurden.
Therapie
Behandlung der akuten Erkrankung
Klinisches Management
Die Behandlung unkomplizierter akuter Formen von Chikungunya-Fieber erfordert lediglich Ruhe, orale Flüssigkeitszufuhr und eine einfache, gut durchgeführte Analgesie [2]. Eine ambulante Behandlung zuhause ist ebenfalls möglich und wird von der WHO empfohlen [19]. Es ist auch wichtig, zwischen Patienten mit einfachen Formen von Chikungunya-Fieber und Patienten mit schweren Formen zu unterscheiden, die eine stationäre Behandlung und Überwachung in einer spezialisierten Umgebung benötigen. Kriterien für eine stationäre Behandlung:
- Vorliegen eines hämodynamischen Versagens,
- Schmerzen, die nicht durch Analgetika der Stufe 1 (Paracetamol) und Stufe 2 (Tramadol oder Codein) kontrolliert werden können,
- Anzeichen von Blutungen,
- Begleiterkrankungen im Zusammenhang mit einer Dekompensation oder
- atypische Symptome (Atem-, Herz-, neurologische, hepatische, hämatologische oder renale Manifestationen).
Die Behandlung von Patienten, die auf einer Intensivstation stationär aufgenommen werden müssen, besteht fast ausschließlich aus einer unterstützenden Behandlung, d.h. einem Management des Flüssigkeitshaushalts, einer mechanischen Beatmung und hämodynamischer Unterstützung bei multiplem Organversagen.
Schmerzbehandlung
Akute Schmerzen gehören zu den Symptomen, die die Betroffenen in der akuten Phase des Chikungunya-Fiebers am stärksten beeinträchtigen. Zur Beurteilung von Schmerzen werden traditionell validierte Schmerzskalen verwendet. Es wird empfohlen, eine multimodale Analgesie durch die Schaffung synergistischer Kombinationen in Abhängigkeit vom Schmerzniveau anzuwenden.
Wenn die Schmerzen anhalten oder wenn sie in der Anfangsphase sofort sehr stark sind, können Analgetika der Stufe 3 (Opioide oder gleichwertige Mittel) eingesetzt werden [20]. Solche Patienten benötigen möglicherweise eine begleitende Behandlung mit Pregabalin, Gabapentin, Amitriptylin oder Clomipramin, trizyklischen Antidepressiva und Antikonvulsiva.
Entzündungshemmende Behandlung
NSAR sind ein wesentlicher Bestandteil der Behandlung von Entzündungen nach Chikungunya-Fieber [19]. Die am häufigsten verwendeten Substanzen sind Naproxen, Ibuprofen und Diclofenac. NSAR sollten nur in Kombination mit einer Koanalgesie eingenommen werden, die mindestens ein Analgetikum der Stufe 1 (Paracetamol) umfasst.
Einige wissenschaftliche Fachgesellschaften, insbesondere in Brasilien, empfehlen die tägliche Einnahme von Hydroxychloroquin bei anhaltenden Symptomen [21]. Die WHO empfiehlt außerdem die tägliche Einnahme von Hydroxychloroquin oder Chloroquin über einen Zeitraum von 4 Wochen bei muskuloskelettalen Symptomen, die auf eine konventionelle symptomatische Behandlung nicht ansprechen [22]. Die Wirksamkeit dieser Behandlung ist jedoch nicht nachgewiesen, und die meisten Empfehlungen anderer Fachgesellschaften sprechen sich gegen ihre Verwendung aus [19]. Eine Gelenkinfiltration (d.h. Gabe von NSAR oder Kortikosteroiden durch intraartikuläre Injektion) empfiehlt sich nicht bei der Behandlung von Chikungunya-Fieber in der akuten Krankheitsphase. Es ist jedoch möglich, eine wiederholte Vereisung schmerzhafter Gelenke und eine vorübergehende Ruhigstellung der betroffenen Gelenke in Betracht zu ziehen, um die Schmerzen zu lindern.
Behandlung der chronischen Erkrankung
Medikamentöse Therapie
Systemisch verabreichte Kortikosteroide werden nicht zur Behandlung der akuten Phase des Chikungunya-Fiebers (innerhalb der ersten 3 Wochen) empfohlen. Sie können aber in der postakuten Phase in niedriger Dosierung oder bei Kontraindikation gegen NSAR oder Opioide verabreicht werden [20]. Ihre Verabreichung ist nur in der postakuten und chronischen Phase (ab 3 Monaten nach der Infektion) von Nutzen, insbesondere bei Patienten mit entzündlichen Manifestationen in den Gelenken (Tenosynovitis, Synovitis, Karpaltunnelsyndrom), neurologischen Manifestationen oder anderen Entzündungen. Sie können auch mit anderen Analgetika (Stufe 1 und 2) kombiniert werden, wenn eine Resistenz gegen die NSAR-Behandlung vorliegt oder sie unwirksam ist.
DMARD wirken gegen rheumatologische Symptome. Diese Arzneimittelklasse wirkt sowohl als Immunmodulator als auch entzündungshemmend [22].
Dabei wird ihre Verwendung je nach Leitlinie ab der 6.–8. Krankheitswoche empfohlen. Methotrexat ist die Behandlung der Wahl, insbesondere bei chronischen Arthritiden. Häufig wird die Kombination mit Hydroxychloroquin und niedrigdosierten Kortikosteroiden empfohlen. In jedem Fall sollten Differenzialdiagnosen, insbesondere eine chronisch-entzündliche Arthritis, ausgeschlossen werden, bevor diese Art der Behandlung in Betracht gezogen wird. Die Behandlung der Post-Chikungunya-Arthritis mit Methotrexat verbesserte die Gelenksymptome bei 75% der Patienten, mit teilweiser Remission bei 8% der Patienten [23]. Allerdings sprachen 9% der Patienten nicht auf die Behandlung an, und bei einer beträchtlichen Anzahl von Patienten traten Nebenwirkungen auf [23]. Eine Auswertung der Wirksamkeit von Methotrexat in Kombination mit Hydroxychloroquin bei einer Patientengruppe in Indien mit einer Nachbeobachtungszeit von 6 Monaten zeigte eine klinische Wirksamkeit bei 49% der behandelten Patienten. In einer anderen Studie wurde die Wirksamkeit der zusätzlichen Gabe von Methotrexat bei Patienten untersucht, die nach 3 Monaten gut durchgeführter Behandlung eine Kombination aus Hydroxychloroquin und Sulfasalazin abgesetzt hatten [22]. Die Studie zeigte eine klinische Verbesserung bei mehr als 90% der Patienten nach 24 Monaten und eine erhöhte Wirksamkeit von Methotrexat bei Patienten, die positiv auf Rheumafaktoren oder Anti-CCP-Antikörper getestet wurden. In einer weiteren Studie wurde die Reaktion auf eine Kombinationstherapie aus Methotrexat, Sulfasalazin und Hydroxychloroquin mit einer 6-wöchigen Behandlung aus Hydroxychloroquin plus niedrig dosierten Kortikosteroiden verglichen. Beide Gruppen erhielten 6 Wochen lang eine Kortikosteroidtherapie. Diese Studie belegte die Wirksamkeit der therapeutischen Kombination mehrerer DMARD mit einer Kortikosteroidtherapie. Dabei war die Wirksamkeit nach 24 Monaten bei der Krankheitsaktivität, der funktionellen Prognose und den Schmerz-Scores nachweisbar [24].
Schließlich wurden andere immunologische Therapeutika wie z.B. Tumornekrosefaktor-Inhibitoren als Alternativen zu DMARD bei Fällen von therapieresistenter Post-Chikungunya-Arthritis vorgeschlagen. Dazu liegen jedoch bisher keine Studienergebnisse vor.
Physikalische Maßnahmen und Physiotherapie
Diese Maßnahmen vervollständigen die Behandlung und zielen darauf ab, die allgemeinen Auswirkungen zu begrenzen, indem die Gelenkbeweglichkeit verbessert und chronische Schmerzen gelindert werden [22]. Der klinische Gesamteindruck für die Wirksamkeit von Maßnahmen wie passiver und aktiver Mobilisierung, Propriozeption und Muskelkräftigung (Training) ist überwiegend positiv [22].
Maßnahmen bei psychosozialen Problemen
Die Lebensqualität von Menschen mit Chikungunya-Fieber kann sich während der chronischen Phase der Krankheit, die durch Gelenk- und neurologische Schäden oder sogar Schäden an anderen Organen gekennzeichnet ist, deutlich verschlechtern.
In der akuten Phase schienen Müdigkeit und eine geringe Thymusaktivität mit Depressivität die Symptome zu sein, die am meisten beeinträchtigten. In einer 2006 auf La Réunion durchgeführten Studie, in der die Auswirkungen des Chikungunya-Fiebers auf Militärpersonal im Alter von 19–55 Jahren untersucht wurden, wurde bei 47% von 662 Patienten eine klinisch signifikante bis sehr signifikante Müdigkeit festgestellt. Diese machte bei 37% der Betroffenen normale Aktivitäten unmöglich. Es wurden auch depressive Symptome festgestellt, mit einem Rückgang der Moral und einer schweren Depression bei 35 bzw. 5% der Patienten.
Zusätzlich zu den Folgen für Morbidität und Mortalität, die direkt auf die chronische Form des Chikungunya-Fiebers zurückzuführen sind, verschlimmert die Infektion bei vielen Patienten bereits bestehende Vorerkrankungen. Während der Epidemie 2005–2006 auf La Réunion waren 237 Todesfälle die direkte oder indirekte Folge des Chikungunya-Fiebers aufgrund der Dekompensation von multimorbiden Patienten. In einer Studie aus dem Jahr 2016 mit 65 Patienten, die während Epidemien in Amerika und der Karibik wegen Chikungunya-Fiebers auf die Intensivstation eingewiesen wurden, wiesen 54 Patienten (83%) eine vorbestehende chronische Erkrankung auf. Von diesen 54 Patienten wurden 27 wegen einer Dekompensation aufgrund einer CHIKV-Infektion eingewiesen [22].
Komplikationen und Auswirkungen auf die Lebensqualität treten jedoch mit Abstand am ehesten in der chronischen Krankheitsphase auf. Eine in Südindien durchgeführte Studie [24] ergab eine erhebliche Verringerung der Lebensqualität bei 403 Patienten, die klinische Symptome von Post-Chikungunya-Arthritis aufwiesen. Im Vergleich zur Kontrollgruppe war die Lebensqualität von Patienten, die nach 3 Monaten noch aktive klinische Symptome von Chikungunya-Fieber aufwiesen, um das 20-Fache, und die von Patienten, die sich erholt hatten, um das 5-Fache verringert. Mit einer schnelleren Genesung waren folgende Faktoren verbunden:
- jüngeres Alter,
- männliches Geschlecht,
- Fehlen von Hautausschlag in der Akutphase,
- weniger als 5 betroffene Gelenke und
- Gelenkmanifestationen, die weniger als 2 Wochen andauerten.
Auffällig ist, dass die asiatische CHIKV-Linie weniger virulent zu sein scheint als die meisten ECSA-Linien, einschließlich der Linie aus dem Indischen Ozean [25]. Diese Linien scheinen mit einem schwereren Verlauf und einer langfristig stärker beeinträchtigten Lebensqualität verbunden zu sein. Nur wenige Studien haben sich auf die Langzeitnachsorge dieser Patienten konzentriert. Es scheint jedoch, dass Patienten mit chronischen Manifestationen mehrere Monate oder sogar Jahre nach der Erstinfektion unter beeinträchtigenden Symptomen leiden [19]. Die am häufigsten beobachteten Anzeichen und Symptome nach einer Nachbeobachtungszeit von mehr als 6 Monaten sind Gelenkschmerzen, Sehnenscheiden- und Sehnenentzündungen mit Verdickung des Synovialgewebes sowie Knochenläsionen, Müdigkeit und Parästhesien. In der Kohorte des Militärpersonals aus La Réunion wurden chronische Schmerzen bei 41% der Patienten als kontinuierlich und bei 59% der Patienten als diskontinuierlich mit Schüben beschrieben [23]. Die chronische Erschöpfung war nach Selbsteinschätzung bei 5% der Patienten behindernd und bei 43% der Patienten sehr schwerwiegend oder schwerwiegend. Die Grundstimmung wurde bei 2% als stark depressiv, bei 38% als demotiviert und bei 44% als antriebslos beschrieben.
Die meisten psychosozialen Probleme werden in der chronischen Phase der Krankheit gemeldet. Dies kann die Inanspruchnahme sozialer Unterstützung erforderlich machen, insbesondere in Form von häuslicher Hilfe oder Besuchen von Pflegepersonal in der Nähe. Bei einem erheblichen Funktionsverlust und Schmerzen, die auf einfache Analgetika nicht ansprechen, kann auch eine psychologische Begutachtung erforderlich sein [22].
Zu diesen Maßnahmen gehören tägliche körperliche Bewegung, manuelle Therapien und Physiotherapie. Die psychosozialen Auswirkungen sind in der chronischen Phase aufgrund von Gelenkschäden größer: Fast 71% der Patienten mit Gelenkschmerzen geben negative Auswirkungen auf ihre Lebensqualität an [2]. Angesichts der erheblichen Verschlechterung der Lebensqualität bei diesen Patienten ist in der chronischen Phase ein multidisziplinärer Ansatz erforderlich, der psychosoziale Unterstützung und körperliche Rehabilitation kombiniert.
Prävention
Impfstoffentwicklung
Lebendimpfstoffe
Nach über 60 Jahren Forschung und Entwicklung von CHIKV-Impfstoffen wurde mit VLA1553 (Ixchiq), einem attenuierten Lebendvakzin, der erste CHIKV-Impfstoff 2023 in den USA zugelassen [26]. Die Zulassung in Europa folgte 2024, mit einer Verfügbarkeit im Markt wird ab dem ersten Quartal 2025 gerechnet. Ein weiterer Impfstoff, bei dem es sich um einen Totimpfstoff handelt, soll noch im selben Jahr folgen. Im Idealfall würde ein CHIKV-Impfstoff schnelle (z.B. innerhalb von maximal 14 Tagen) und dauerhafte (z.B. länger als 2 Jahre anhaltende) Immunreaktionen hervorrufen. Das ist wichtig, da Chikungunya-Fieberausbrüche zeitlich und geografisch unvorhersehbar sind und zwischen identifizierten Fällen und dem Höhepunkt der Epidemie nur eine kurze Zeitspanne liegt. Darüber hinaus würde ein optimaler CHIKV-Impfstoff Schutz vor allen potenziellen CHIKV-Varianten bieten. Denn der für einen Ausbruch verantwortliche Virusstamm ist ähnlich unvorhersehbar wie beim Dengue-Fieber, auch wenn die CHIKV-Varianten genetisch weniger vielfältig sind.
Das Chikungunya-Fieber betrifft in der Regel Länder mit niedrigem und mittlerem Einkommen. Deshalb muss ein Impfstoff für die am stärksten gefährdeten Bevölkerungsgruppen erschwinglich sein und sich in tropischen Umgebungen leicht lagern und transportieren lassen.
Die explosionsartige Ausbreitung des Chikungunya-Fiebers erschwert die Durchführung groß angelegter Phase-III-Wirksamkeitsstudien zusätzlich. Denn es werden Surrogatmarker für die durch den Impfstoff induzierte Immunität benötigt, die eine Bewertung durch die Aufsichtsbehörden ermöglichen. Erfreulicherweise deuten seroepidemiologische Studien nach natürlichen CHIKV-Infektionen darauf hin, dass neutralisierende Antikörperwerte wahrscheinlich zuverlässig vorhersagen, wie gut eine geimpfte Person vor einer Infektion geschützt ist. Diese neutralisierenden Antikörperwerte können über Jahrzehnte hinweg bestehen bleiben. Daher wurde seitens der Zulassungsbehörden der Nachweis einer hohen Immunogenität als ausreichender Parameter für den Beleg der Protektion akzeptiert.
Derzeit ist VLA1553, ein abgeschwächter Lebendimpfstoff in Einzeldosisform, der am weitesten entwickelte CHIKV-Impfstoff. Der Impfstoff VLA1553 wurde unter Verwendung eines CHIKV-ECSA-Stammes entwickelt, der während des Ausbruchs auf La Réunion im Jahr 2006 isoliert wurde [26]. Eine Phase-I-Studie mit 3 Dosen von VLA1553 ergab, dass niedrige und mittlere Impfstoffdosen gut verträglich und immunogen waren. Folgestudien an Mäusen und nicht menschlichen Primaten zeigten, dass der passive Transfer von Serumproben aus der Phase-I-Studie zu VLA1553 zu einem Schutz gegen eine Infektion mit CHIKV führte. Im Jahr 2022 zeigten die Ergebnisse einer in den USA durchgeführten randomisierten, kontrollierten Studie mit einer Einzeldosis von VLA1553, dass fast 98,9% der Teilnehmer, darunter auch Personen im Alter von 65 Jahren oder älter, nach einer Einzeldosis den vorgeschlagenen Schwellenwert für die Seroprotektion erreicht hatten. Deshalb wurde der Impfstoff als sicher und gut verträglich eingestuft. Die Nachbeobachtung einer Untergruppe von Teilnehmern wird 5 Jahre lang fortgesetzt. In Brasilien läuft eine zusätzliche Studie mit Jugendlichen (VLA1553–321), in der Hoffnung, dass Brasilien als eines der ersten Länder in einem endemischen Gebiet eine Zulassung erteilt.
Totimpfstoffe
Obwohl VLA1553, ein Lebendimpfstoff, der am weitesten entwickelte CHIKV-Impfstoff ist, haben Lebendimpfstoffe Nachteile. So müssen für Lebendimpfstoffe große Mengen an Lebendviren in hochgradig abgeschirmten und sicheren Einrichtungen gezüchtet werden. Darüber hinaus verursachen abgeschwächte Lebendimpfstoffe im Allgemeinen häufig eine stärkere systemische Reaktion wie hohes Fieber und vorübergehende Arthralgie und Arthritis, die auch in einigen Studien zu VLA1553 berichtet wurden. Vor allem können Lebendimpfstoffe aber bei bestimmten gefährdeten Bevölkerungsgruppen nicht eingesetzt werden, insbesondere bei Immunsupprimierten. Als Alternative wurde ein Totimpfstoff auf der Basis von VLP (virusähnlichen Partikeln) entwickelt. VLP bestehen aus viralen Proteinen, die sich selbst zu Strukturen zusammenlagern, die dem echten Virus ähneln, sich aber nicht replizieren.
Im Jahr 2014 wurden die Ergebnisse der ersten klinischen Studie zu einem CHIKV-VLP-Impfstoff veröffentlicht, der aus den CHIKV-Proteinen E1, E2 und Kapsid eines westafrikanischen Stammes besteht [27]. Er erwies sich als sicher und immunogen. Jedoch waren 2 Dosen im Abstand von einem Monat erforderlich, um nach 8 Wochen die höchste Immunogenität zu erreichen. Angesichts der explosionsartigen Ausbreitung von Chikungunya-Fieber ist diese Reaktion wahrscheinlich zu langsam, um wirksam zu sein, insbesondere auf Bevölkerungsebene. Daher bestand der nächste Schritt der VLP-Entwicklung darin, zum Zeitpunkt der Verabreichung ein Adjuvans hinzuzufügen, um die Dosis zu reduzieren.
Im Jahr 2022 wurde eine Phase-II-Studie mit PXVX0317 durchgeführt, einem VLP in Kombination mit Aluminiumhydroxid [27]. Diese Studie ergab, dass das Adjuvans die Neutralisierungsreaktion nach der ersten Injektion erheblich verstärkte. Dabei stiegen die Seropositivitätsraten innerhalb von nur 7 Tagen an und erreichten am Tag 57 100%. Die Einzeldosis verursachte einen schnellen, 10-fachen Anstieg neutralisierender Antikörpertiter innerhalb einer Woche und einen ca. 100-fachen Anstieg nach 28 Tagen, mit einem dauerhaften Anstieg bis zu 2 Jahren. Darüber hinaus löste eine Auffrischungsdosis 18 Monate nach der ersten aktiven Injektion eine starke immunologische Gedächtnisreaktion aus. Gelenkschmerzen wurden bei 6% der Teilnehmer nach der ersten Impfung berichtet, verglichen mit Gelenkschmerzen bei 12% der Freiwilligen, die VLA1533 erhielten. Das Einzeldosis-Hochdosis-Schema wurde in einer klinischen Phase-III-Studie getestet. Dabei ergab sich eine Serokonversionsrate von 96,8% nach 15 Tagen bei einer Reaktogenität, die weitgehend auf Placeboniveau lag. Dieser Impfstoff ist seit Mai 2025 verfügbar. Weitere Impfstoffkandidaten sind in Entwicklung und werden ggf. in den kommenden Jahren zugelassen werden.
Vektorkontrolle
CHIKV wird hauptsächlich über die Mückenvektoren Aedes aegypti und Aedes albopictus verbreitet. Daher können traditionelle Methoden der Mückenbekämpfung zur Eindämmung von Chikungunya-Fieberausbrüchen eingesetzt werden. Theoretisch gehören dazu das großflächige Versprühen von chemischen Adultiziden und Larviziden und mechanische Methoden zur Beseitigung von stehendem Wasser.
In der Realität hat sich das CHIKV jedoch vollständig an die Übertragungszyklen in Städten angepasst, und Ausbrüche treten zunehmend in dicht besiedelten Gebieten auf, in denen ein großflächiges Versprühen giftiger Chemikalien nicht möglich ist [3]. Darüber hinaus erreicht das Versprühen von Insektiziden im Freien nicht Aedes-aegypti-Mücken in Innenräumen [4]. Der Einsatz chemischer Insektizide wird auch durch die schnelle Resistenzbildung eingeschränkt.
Bei Mückenvektoren umfassen diese Methoden das Massenfangen mit klebrigen Gravidfallen (Fallen für schwangere Weibchen), trockene, attraktive, giftige Zuckerköder, elektromechanische Fallen und Fallen in Kombination mit dem Versprühen von extrem geringen Mengen an Insektiziden [6]. Ein neuartiger Ansatz ist die Verwendung von inaktivierten Hefe-Interferenz-RNA-Formulierungen, die für die Abtötung von Mückenlarven optimiert sind [6]. Dabei werden Tabletten mit interferierender RNA, die wichtige Mückengene zum Schweigen bringen, in Fallenbehältern in Wasser gegeben.
Schließlich wurden genetische Kontrolltechnologien entwickelt, um Mückenpopulationen zu unterdrücken oder zu verändern und so die Übertragung von viralen Krankheitserregern zu reduzieren. Zu diesen Technologien gehört die Einführung männlicher Mücken, die mit dem intrazellulären Parasiten Wolbachia infiziert sind, und transgener Mücken, die sterile Weibchen hervorbringen oder die virale Replikation von Zielpathogenen hemmen.
Es ist unwahrscheinlich, dass eine der genannten Mückenbekämpfungsmethoden bei alleiniger Anwendung eine vollständige Wirksamkeit bei der Bekämpfung von CHIKV aufweist. Wenn sie jedoch in einem integrierten Bekämpfungsprogramm mit anderen synergistischen Mückenbekämpfungsinstrumenten und Impfstoffen eingesetzt wird, kann eine wirksame Bekämpfung erreicht werden.
Literatur
[1] Azar SR, Campos RK, Bergren NA. Epidemic alphaviruses: ecology, emergence and outbreaks. Microorganisms 2020; 8: 1167
[2 ] Bartholomeeusen K, Daniel M, LaBeaud DA. Chikungunya fever. Nat Rev Dis Primers 2023; 9: 17
[3 ] Kramer IM, Pfeiffer M, Steffens O. The ecophysiological plasticity of Aedes aegypti and Aedes albopictus concerning overwintering in cooler ecoregions is driven by local climate and acclimation capacity. Sci Total Environ 2021; 778: 146128
[4 ] Zaid A, Burt FJ, Liu X. Arthritogenic alphaviruses: epidemiological and clinical perspective on emerging arboviruses. Lancet Infect Dis 2021; 21: e123-e133
[5 ] Mehand MS, Al-Shorbaji F, Millett P. The WHO R&D Blueprint: 2018 review of emerging infectious diseases requiring urgent research and development efforts. Antivir Res 2018; 159: 63-67
[6 ] Kolimenakis A, Heinz S, Wilson ML. The role of urbanisation in the spread of Aedes mosquitoes and the diseases they transmit – a systematic review. PLoS Negl Trop Dis 2021; 15: e0009631
[7 ] de Lima Cavalcanti TYV, Pereira MR, de Paula SO. A review on chikungunya virus epidemiology, pathogenesis and current vaccine development. Viruses 2022; 14: 969
[8 ] Tsetsarkin KA, Weaver SC. Sequential adaptive mutations enhance efficient vector switching by Chikungunya virus and its epidemic emergence. PLoS Pathog 2011; 7: e1002412
[9 ] Nsoesie EO, Kraemer MUG, Golding N. Global distribution and environmental suitability for chikungunya virus 1952 to 2015. Eurosurveillance 2016; 21
[10] Jelinek T. CRM Handbuch Reisemedizin 2025. Düsseldorf: CRM Centrum für Reisemedizin; 2024
[11 ] Hoornweg TE, van Duijl-Richter MKS, Nuñez NVA. Dynamics of chikungunya virus cell entry unraveled by single-virus tracking in living cells. J Virol 2016; 90: 4745-4756
[12 ] Pingen M, Bryden SR, Pondeville E. Host inflammatory response to mosquito bites enhances the severity of Arbovirus infection. Immunity 2016; 44: 1455-1469
[13 ] Hoarau JJ, Jaffar Bandjee MC, KreibichTrotot P. Persistent chronic inflammation and infection by Chikungunya arthritogenic alphavirus in spite of a robust host immune response. J Immunol 2010; 184: 5914-5927
[14 ] Suhrbier A. Rheumatic manifestations of chikungunya: emerging concepts and interventions. Nat Rev Rheumatol 2019; 15: 597-611
[15 ] Economopoulou A, Dominguez M, Helynck B. Atypical Chikungunya virus infections: clinical manifestations, mortality and risk factors for severe disease during the 2005–2006 outbreak on Réunion. Epidemiol Infect 2009; 137: 534-541
[16 ] Rodríguez-Morales AJ, Cardona-Ospina J, Urbano-Garzón SF. Prevalence of post-chikungunya infection chronic inflammatory arthritis: a systematic review and meta-analysis. Arthritis Care Res 2016; 68: 1849-1858
[17 ] Paixão ES, Rodrigues LC, da Conceição N Costa M. Chikungunya chronic disease: a systematic review and meta-analysis. Trans R Soc Trop Med Hyg 2018; 112: 301-316
[18 ] Moreira J, Brasil P, Dittrich S. Mapping the global landscape of chikungunya rapid diagnostic tests: a scoping review. PLoS Negl Trop Dis 2022; 16: e0010067
[19 ] Webb E, Michelen M, Rigby I. An evaluation of global Chikungunya clinical management guidelines: a systematic review. EClinicalMedicine 2022; 54: 101672
[20 ] Zaid A, Gérardin P, Taylor A. Chikungunya arthritis: implications of acute and chronic inflammation mechanisms on disease management. Arthritis Rheumatol 2018; 70: 484-495
[21 ] Antunes de Brito CA, von Sohsten AKA, de Sá Leitão CC. Pharmacologic management of pain in patients with Chikungunya: a guideline. Rev Soc Bras Med Trop 2016; 49: 668-679
[22 ] World Health Organization (WHO). Guidelines on clinical management of Chikungunya fever. New Delhi (India): World Health Organization; 2008. https://iris.who.int/bitstream/handle/10665/205178/B3234.pdf (Zugriff: 10.11.2024)
[23 ] Javelle E, Ribera A, Degasne I. Specific management of post-chikungunya rheumatic disorders: a retrospective study of 159 cases in Reunion Island from 2006–2012. PLoS Negl Trop Dis 2015; 9: e0003603
[24 ] Ravindran V, Alias G. Efficacy of combination DMARD therapy vs. hydroxychloroquine monotherapy in chronic persistent chikungunya arthritis: a 24-week randomized controlled open label study. Clin Rheumatol 2017; 36: 1335-1340
[25 ] Doran C, Gerstenbluth I, Duits A. The clinical manifestation and the influence of age and comorbidities on long-term chikungunya disease and health-related quality of life: a 60-month prospective cohort study in Curaçao. BMC Infect Dis 2022; 22: 948
[26 ] Valneva. Valneva initiates rolling submission of FDA biologics license application for its single-shot Chikungunya vaccine candidate, 2022. https://valneva.com/press-release/valneva-initiates-rolling-submission-of-fda-biologics-license-application-for-its-single-shot-chikungunya-vaccine-candidate/ (Zugriff: 10.11.2024)
[27 ] Bennett SR, McCarty JM, Ramanathan R. Safety and immunogenicity of PXVX0317, an aluminium hydroxide-adjuvanted chikungunya virus-like particle vaccine: a randomised, double-blind, parallel-group, phase 2 trial. Lancet Infect Dis 2022; 22: 1343-1355
[28] Babaeimarzangou SS, Zaker H, Soleimannezhadbari E. Vaccine development for zoonotic viral diseases caused by positive-sense single-stranded RNA viruses belonging to the Coronaviridae and Togaviridae families (Review). Exp Ther Med 2022; 25: 42
[29] Malonis RJ, Earnest JT, Kim AS. Near-germline human monoclonal antibodies neutralize and protect against multiple arthritogenic alphaviruses. Proc Natl Acad Sci USA 2021; 118: e2100104118
Autor: Prof. Tomas Jelinek